Søknad om vesentlig endring i klinisk studie
Publisert:
|
Oppdatert:
Endringer
Innhold på siden
Hva er en vesentlig endring?
Etter at en klinisk studie er godkjent under forordningen, kan sponsor gjøre følgende endringer av studiedokumentasjonen:
-
Vesentlige endringer (art 2.2.13) : Krever søknad om godkjenning i Clinical Trials Information System (CTIS).
-
Endringer som ikke er vesentlige, men som er relevante for medlemslandenes mulighet for å overvåke studien (art 81.9): Sponsor skal oppdatere relevant informasjon i CTIS.
-
Ikke-vesentlige endringer (endringer som ikke vurderes som vesentlige og som ikke er relevante for medlemslandenes mulighet for å overvåke studien): Krever ikke søknad I CTIS.
En endring anses for vesentlig dersom:
-
Endringen kan ha en vesentlig påvirkning på forsøkspersonenes sikkerhet, helse eller rettigheter.
-
Endringen kan ha en vesentlig påvirkning på robustheten eller påliteligheten til de kliniske dataene som genereres i forbindelse med utprøvingen.
Definisjon på vesentlig endring i forordningen:
“Any change to any aspect of the clinical trial which is made after notification of a decision referred to in Articles 8, 14, 19, 20 or 23 of the CTR and which is likely to have a substantial impact on the safety or rights of the subjects or on the reliability and robustness of the data generated in the clinical trial"
Det er sponsors ansvar å vurdere om en endring er vesentlig. Eksempler på vesentlige og ikke-vesentlige endringer finnes i Regulation (EU) No 536/2014 Questions & Answers, Annex IV.
Søknaden
CTIS tillater saksbehandling av én søknad om gangen. Dette betyr at en søknad om vesentlig endring ikke kan sendes inn i CTIS så lenge det er pågående saksbehandling av andre søknader som gjelder samme kliniske studie.
Godkjenningsprosedyren for vesentlige endringer er beskrevet i forordningen, Chapter III Authorisation procedure for a substantial modification of a clinical trial.
For informasjon om hvordan søknaden opprettes i CTIS, se EMA Online training module 10
Hva skal en søknad om vesentlig endring inneholde?
Det må angis om søknaden om vesentlig endring gjelder del I, del II eller både del I og del II.
Dersom endringene gjelder flere utprøvinger med samme sponsor og samme utprøvingslegemiddel kan sponsor sende en samlet søknad om vesentlig endring. De relevante utprøvingene må listes i følgebrev med EU CT nummer og kodenummer for endringen "Modification Code Number".
En sjekkliste for hvilken dokumentasjon som skal vedlegges søknaden og som skal sendes inn via CTIS finnes i Regulation (EU) No 536/2014, Annex II Application Dossier for Substantial Modification
Følgebrev
For informasjon om hvilke opplysninger som skal inkluderes i følgebrevet, se Forordningen, Annex II, del B "Cover letter".
Fakturainformasjon
Vi ber om at fakturainformasjon lastes opp under “Proof of Payment of Fee" under “Form", del I av søknaden i CTIS, og ikke i følgebrevet.
Søknadsskjema
Endringsskjema "Modification Application Form" skal fylles ut.
Dersom endringen medfører forandringer i det opprinnelig innsendte søknadsskjemaet "EU Application Form" i CTIS så må dette oppdateres.
Dokumentasjon
-
Reviderte dokumenter (hele dokumentet eller et utdrag) skal sendes inn i en versjon som viser både den tidligere og den nye ordlyden (track changes).
-
En "ren" versjon av de reviderte dokumentene må også innsendes.
-
Dersom endringene i et dokument er mange og utspredt skal endringene oppsummeres (gammel vs. ny tekst) og begrunnes.
Alle endrede dokumenter må oppdateres med korrekt dato og versjonsnummer.
For mer informasjon om hvordan endringene skal beskrives, se Regulation (EU) No 536/2014, Annex II, Section D "Description of the modification".
Kompletterende informasjon
Hvis aktuelt skal søknaden kompletteres med for eksempel en oppsummering av data, oppdatert versjon av nytte/risiko og konsekvenser for forsøkspersoner som allerede er inkludert i utprøvingen.
Se Regulation (EU) No 536/2014, Annex II, del E "Supporting information".
Tidslinje
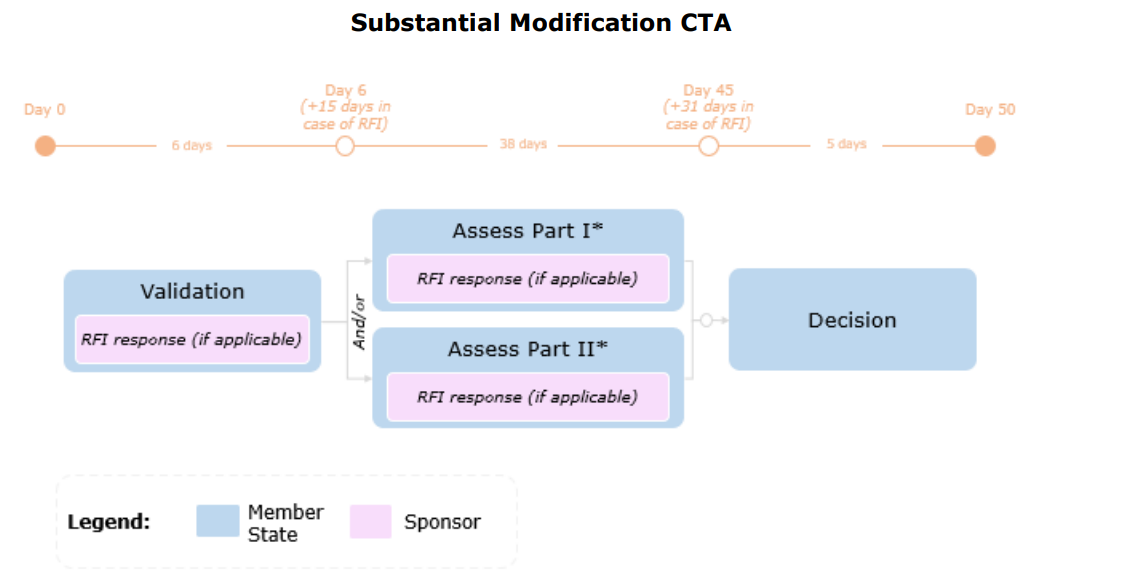
Endringer i henhold til Artikkel 81.9
CTIS skal oppdateres av sponsor dersom det gjøres endringer som ikke er vesentlige endringer, men som er relevante for medlemslandenes overvåkning av studien.
CTR Article 81.9: The sponsor shall permanently update in the EU database information on any changes to the clinical trials which are not substantial modifications but are relevant for the supervision of the clinical trial by the Member States concerned.
Ikke-vesentlige endringer
Ikke-vesentlige endringer er endringer som ikke vurderes som vesentlige og ikke er relevante for medlemslandenes mulighet for å overvåke studien. Disse endringene krever ikke søknad i CTIS.
Følgebrevet ved neste søknad om vesentlig endring skal inneholde en oversikt over alle ikke-vesentlige endringer som er gjort siden forrige godkjenning.
I mellomtiden skal ikke-vesentlige endringer dokumenteres i Trial Master File.
For mer informasjon om ikke-vesentlige endringer, se Regulation (EU) No 536/2014 Questions & Answers, Section 3.4.
Gebyr
Fakturainformasjon må oppgis i del 1 (Proof of payment) av søknaden i CTIS. Det blir sendt faktura etter at søknad er mottatt. Fakturaen vil påføres EU CT nummer og DMPs saksnummer.
Klikk her for informasjon om gebyrer for kliniske utprøvinger av legemidler.
Relevante lenker
-
QUESTIONS & ANSWERS, Clinical Trials Regulation (EU) No 536/2014, chapter 3
-
Oversikt over nasjonale krav til del 2 finnes på REK-portalen.
- CTIS online training